Até o momento, a secretaria já aplicou mais de 7,2 milhões de doses contra a covid-19. Atualmente, estão disponíveis a primeira e a segunda dose para crianças de 6 meses a 2 anos; a dose de reforço para todas as faixas etárias a partir de 3 anos, incluindo crianças, adolescentes, adultos e idosos.
Por Redação, com ABr - de Brasília
O Distrito Federal iniciou esta semana a aplicação da dose de reforço da vacina contra a covid-19 para crianças de 3 e 4 anos que receberam a CoronaVac.
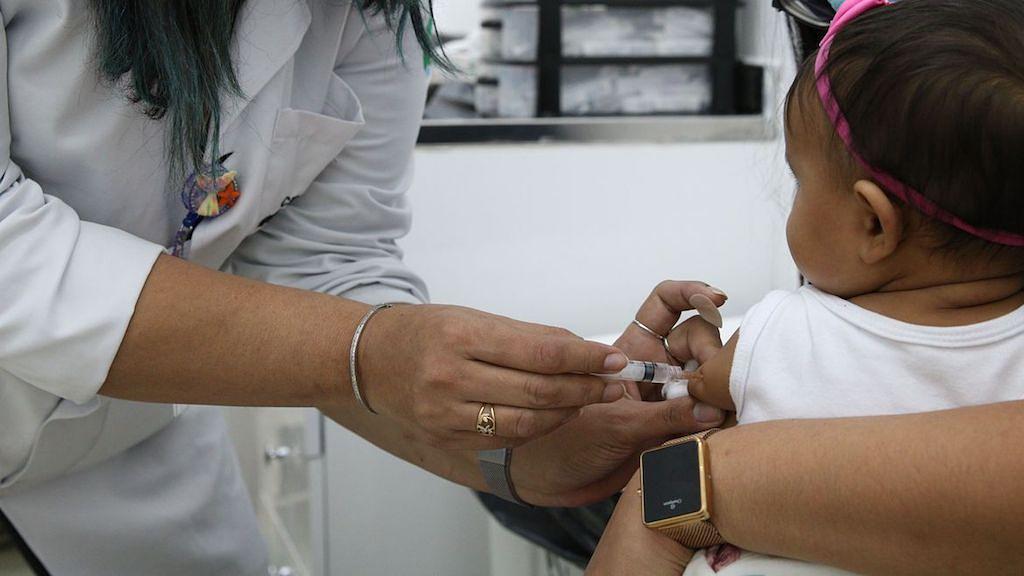
De acordo com a secretaria de saúde, é preciso aguardar um intervalo de pelo menos quatro meses desde a aplicação da segunda dose.
O imunizante utilizado para reforço nessa faixa etária é o Pfizer Baby, disponível em 37 unidades básicas de saúde (UBS) do Distrito Federal.
Os locais, segundo a secretaria, têm estoque disponível e estão aptos a receber esse contingente. Confira a lista completa de pontos de vacinação aqui.
Balanço
Até o momento, a secretaria já aplicou mais de 7,2 milhões de doses contra a covid-19. Atualmente, estão disponíveis a primeira e a segunda dose para crianças de 6 meses a 2 anos; a dose de reforço para todas as faixas etárias a partir de 3 anos, incluindo crianças, adolescentes, adultos e idosos; e o segundo reforço para quem tem menos de 40 anos.
Anvisa analisa uso emergencial de nova vacina
Um pedido de Autorização de Uso Emergencial para a versão da vacina bivalente contra a covid-19, desenvolvida pelo laboratório farmacêutico Moderna e comercializada pela Adium, foi apresentado à Agência Nacional de Vigilância Sanitária (Anvisa), na última sexta-feira.
Segundo a Anvisa, a vacina bivalente contém uma mistura de cepas do vírus SARS-Cov-2 e promete conferir maior proteção à variante Ômicron, quando comparada com vacinas monovalentes. Por sua transmissibilidade, observa a agência, a variante Ômicron causa preocupação às autoridades sanitárias do país.
A Adium havia apresentado o pedido de registro da vacina, em janeiro. "Este pedido se encontra em análise pela equipe técnica da Anvisa. Porém, a empresa decidiu protocolar a Autorização de Uso Emergencial, paralelamente ao pedido do registro, de acordo com a manifestação favorável do Ministério da Saúde, conforme previsto no parágrafo único do Art. 1º da Resolução (RDC) 688, de 13 de maio de 2022", explicou a agência, em nota.
Uso Emergencial
Uma vez recebido o pedido de Autorização de Uso Emergencial, a Anvisa tem 30 dias para concluir sua avaliação. Esse prazo é interrompido sempre que for necessário solicitar à empresa a complementação de informações ou esclarecimentos sobre os dados de qualidade, de eficácia e de segurança apresentados.